Mekanisme Reaksi Bersaing SN1 dan E1
Perbedaan mendasar antara
kompetisi SN1 / E1 dan kompetisi SN2 / E2 adalah pada
langkah mekanistik pertama, atau dalam pembentukan ion karbenium, yang
sepenuhnya identik baik dalam eliminasi E1 dan reaksi SN1. Jadi,
pada langkah mekanistik pertama, reaksi E1 dan SN1 jelas tidak bersaing.
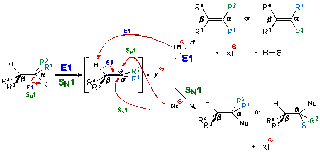
Persaingan muncul dari alternatif mekanistik mengikuti langkah pertama. Sama
seperti dalam kompetisi SN2 / E2, nukleofil (basa) dalam kompetisi SN1
/ E1 pada dasarnya bifungsional - yaitu, ia dapat mengabstraksi proton β dari
ion karbenium dalam eliminasi E1, atau secara langsung dapat menyerang α karbon
ion karbenium dalam reaksi SN1.
Lain dengan
kompetisi SN2 / E2, laju reaksi E1 dan SN1
bergantung pada struktur substrat tidak bertentangan, tapi dari jenis yang
sama. Reaksi SN1 ini, serta eliminasi E1, itu berjalan sangat lambat dengan
senyawa heteroalkil primer, membuat mereka itu biasanya sepenuhnya dilampaui
oleh mekanisme bimolekul yang sesuai (SN2 / E2). Jika kita lihat pada senyawa heteroalkil tersier, reaksi unimolecular (SN1
/ E1) berjalan lebih cepat jika kita bandingan dengan reaksi bimolecular (SN2
/ E2).
Gbr.1
Primer
α karbon: hijau
Gbr.2
sekunder
α karbon: hijau
Gbr.3
tersier
α karbon: hijau
Langkah dalam menentukan laju reaksi E1 dan SN1
yang identik ini yaitu pembentukan ion karbenium, yang bertanggung jawab pada
ketergantungan yang sama terhadap laju reaksi pada struktur substratnya. Karena
stabilisasi muatan positif ion karbenium oleh substituen alkil, energi
aktivasinya itu lebih rendah pada pembentukan ion karbenium tersier dibandingkn
untuk ion sekunder, atau, khususnya, untuk ion karbenium primer. Dengan begitu
laju reaksi senyawa heteroalkil tersier lebih besar jika dibandingkan dengan
senyawa heteroalkil sekunder atau primer (dalam SN1 dan E1).
Reaksi SN1 biasanya lebih dominan jika kita lihat dengan reaksi E1. Reaksi SN1 biasanya lebih dominan jika kita lihat dengan reaksi E1. Walaupun suhu sudah kita perbesar sedikit, guna memperbesar proporsi dari reaksi E1 ini, masih saja SN1 yang menjadi dominan.
Permasalahan
- Mengapa reaksi SN1 dan E1 pada senyawa heteroalkil primer itu reaksinya berjalan sangat lambat?
- Jelaskan pada saat keadaan yang bagaimanakah produk yang dihasilkan lebih dominan SN1?
- Bagaimanakah pengaruh suhu pada reaksi bersaing SN1 dan E1 ini?
Referensi



Hallo wialiana nama saya Nur Khalishah .Saya akan mencoba menjawab permasalahan pertama seperti kita tahu bahwa baik reaksi SN1 maupun E1 dalam proses terjadinya sama-sama memerlukan perantara karbokation. kestablian karbokation ini akan semakin naik, artinya akan semakin stabil dari primer-sekunder-tersier. hal inilah yang menyebabkan mengapa reaksi berjalan lambat pada senyawa primer dan berjalan cepat pada senyawa tersier. makin stabil karbokation yang terbentuk, makin cepat pula reaksi yang terjadi.
BalasHapusterima kasih. semoga membantu.
Desti Ramadhani (A1C118010)
BalasHapus3. Menurut saya pengaruh suhu juga mempengaruhi terhadap reaksi bersaing SN1 dan E1
Jika suhu nya sangat tinggi maka kemungkinan produk E1 lah yg akan terbentuk walaupun dalam hal ini tetap SN1 tetap mendominasi dalam reaksi bersaing.
Hai wisliana!
BalasHapusSaya Khusnul Khotimah (A1C118039) akan mencoba menjawab permasalahan no 2. Suatu reaksi Sn 1 dapat menang bersaing melawan E1 karena pada kondisi tersebut,adanya pengaruh dari nukleofil lemah/basa lemah yang mana sejatinya nukleofil lemah (H2O) lebih menyukai Sn 1 dibandingkan dengan E1.