Contoh reaksi kondensasi aldol
Jumat, 27 Maret 2020
Mekanisme Reaksi- reaksi Adisi pada Aldehid dan Keton
Mekanisme Reaksi- reaksi Adisi pada
Aldehid dan Keton
Apa
itu Aldehida dan Keton?
Jika
kita melihat ke dapur, maka peluang besar kita akan menjumpai beberapa aldehida
ada di sekitar kita. Mulai dengan vitamin A yang terdapat dalam wortel hingga
formika yang ada di atas meja, aldehida mungkin terdengar sulit, akan tetapi
sebenarnya aldehid itu bagian dari keseharian kita. Aldehid juga bisa dijumpai
selain dari vitamin A seperti vitamin B6, hormon, dan semua gula penting,
glukosa. Aldehida bisa kita digunakan untuk pembuatan juga, untuk zat antara
sebagai pewarna, obat-obatan, dan plastik.
Tetapi,
bagaimana dengan keton? Keton sama pentingnya dalam kehidupan kita.
Molekul-molekul ini juga timbul dalam gula dan hormon, dan merupakan produk
sampingan yang dibutuhkan dari reaksi metabolisme. Contoh keton yang sering
dijumpai untuk keperluan industry ialah aseton, seperti zat yang kita jumpai
untuk menghapus cat kuku. Tapi keton lebih dari itu dibutuhkannya untuk kita.
Keton seperti aseton digunakan sebagai pembentuk lak, pernis, resin, cat, dan
juga bahan peledak.
Aldehida
dan keton itu unik karena mempunyai gugus karbonil, atau karbon yang terikat
pada oksigen dengan ikatan rangkap. Aldehida mempunyai karbon dalam gugus
karbonil yang terikat pada karbon lain, hidrogen dan oksigen.
Struktur Aldehida dan Keton
- Karbon karbonil dari aldehida atau keton adalah hibridisasi sp2.
- Sudut ikatan mendekati 120 ° (trigonal planar).
Ikatan
rangkap karbon-oksigen terdiri dari:
- Sebuah Ikatan C-O
- Sebuah ikatan C = O
Kita
bisa membandingkan panjang ikatan C = O panjangnya dari ikatan rangkap C = C
Keton,
bagaimanapun, memiliki karbon dalam gugus karbonil yang terikat pada oksigen,
dan dua gugus tambahan, tetapi tidak ada hidrogen.
Properti Aldehida dan Keton
- Aldehida dan keton adalah molekul polar karena ikatan C = O memiliki sebuah momen dipol:
- Polaritasnya membuat aldehida dan keton memiliki titik didih yang lebih tinggi daripada alkena dengan berat molekul serupa.
- Aldehida dan keton bukan donor ikatan hidrogen (mereka tidak dapat menyumbang sebuah proton); oleh karena itu, mereka memiliki titik didih yang lebih rendah daripada alkohol yang serupa berat molekul.
- Aldehida dan keton adalah akseptor ikatan hidrogen; ini membuat mereka memilikinya kelarutan yang cukup besar dalam air. Keton seperti aseton adalah pelarut yang baik karena mereka larut baik air dan senyawa organik. Ingatlah bahwa aseton adalah pelarut aprotik kutub.
Reaksi Aldehid dan Keton
Reaksi
aldehida dan keton dapat dibagi menjadi dua utama kategori:
- Reaksi gugus karbonil
- Reaksi yang melibatkan alpha Carbon
Reaksi
gugus karbonil dibagi menjadi tiga kelompok utama:
- Reaksi dengan asam
- Oksigen karbonil basa lemah.
- Baik asam Bronsted dan Lewis dapat berinteraksi dengan sepasang elektron bebas oksigen karbonil.
2. Reaksi Adisi
3. Reaksi Oksidasi
Reaksi Adisi
ü Kelompok
karbonil dalam aldehida dan keton mengalami reaksi adisi.
ü Ini
adalah salah satu reaksi paling penting dari gugus karbonil.
Reaksi
adisi terjadi oleh dua mekanisme yang berbeda:
1. Penambahan
berbasis katalis (dalam kondisi dasar atau netral)
2. Penambahan
yang dikatalisis oleh asam (dalam kondisi asam)
1. Reaksi Adisi Nukleofil Air (H2O)
Air bisa mengadisi suatu gugus
karbonil, guna menghasilkan 1,1-diol, yang bisa dikatakan gem-diol, atau
hidrat. Reaksi ini bersifat reversible, dan seringnya kesetimbangan ini ada
pada sisi karbonil.
Mekanisme
Hidrasi
Mekanisme
Umum
2. Reaksi Adisi (HCN)
Hidrogen sianida memasuki ikatan
rangkap C=O pada aldehid dan keton membentuk senyawa yang biasa dikenal sebagai
hidroksinitril. Senyawa-senyawa ini sering dikatakan sebagai sianohidrin. Reaksi
berlangsung sangat lambat dengan menggunakan hidrogen sianida murni.
Mekanisme
Reaksinya:
Karena
perbedaan elektronegativitas dalam atom karbon dan atom oksigen, ikatan C = O
menunjukkan perilaku kutub. Ini, pada gilirannya, menghasilkan perolehan
muatan parsial negatif pada atom oksigen dan muatan positif parsial pada atom
karbon. Muatan positif parsial atom karbon akan menarik ion sianida
H + CN - . Ikatan rangkap C = O akan terputus dan
terjadi perkembangan ikatan C-CN yang baru. Selanjutnya, oksigen yang
tidak stabil akan menarik H+ dari Hidrogen sianida.
3. Reaksi Adisi Pereaksi Grignard
Reaksi suatu reagensia Grignard
dengan senyawa yang karbonil adalah contoh lain adisi nukleofilik yang terdapat
reagensia Grignard karbon positif dari suatu gugus karbonil. Walaupun demikian,
adisi dari suatu reagensia Grignard tidaklah suatu reversible yaitu dapat
balik. Deretan reaksi terdiri dari dua tahap yang pisah :
- Reaksi antara reagensia Grignard dan senyawa karbonil
- Hidrolisis magnesium aloksida guna membentuk alkohol.untuk tidak dilupakan bahwa rekasi Grignard (dari) formaldehida menghasilkan alkohol primer, aldehid lain menghasilkan alkohol seknder, dan keton menghasilkan alkohol tersier.
Mekanisme Umum
4. Adisi Nukleofilik dengan Alkohol (R-OH)
Reaktivitas Aldehida dan Keton
Aldehida
lebih reaktif dan mudah mengalami reaksi adisi nukleofilik dibandingkan dengan
keton. Aldehida menunjukkan konstanta kesetimbangan yang lebih baik untuk
reaksi adisi daripada keton karena efek elektronik dan sterik
Langkah
penentuan laju sehubungan dengan reaksi adisi nukleofilik yang dikatalisis basa
dan reaksi adisi nukleofilik yang dikatalisis asam adalah langkah di mana
nukleofil bekerja pada karbon karbonil.
Namun,
proses protonasi terjadi pada karbonil oksigen setelah tahap penambahan
nukleofilik jika terjadi kondisi katalisis asam. Karakter karbokation dari
struktur karbonil meningkat karena protonasi dan dengan demikian membuatnya
lebih elektrofilik.
Equilibria dalam Reaksi Penambahan
Karbonil
•
Stabilitas Reaktan:
-
Ingat bahwa gugus alkil menstabilkan ikatan rangkap (lebih tersubstitusi alkena
lebih stabil daripada alkena yang kurang tersubstitusi)
-
Ini bekerja untuk C = O ikatan rangkap juga
-
Keton lebih stabil daripada aldehid keton kurang disukai daripada penambahan
aldehida
•
Stabilitas Produk:
-
produk penambahan keton kurang disukai daripada aldehida produk tambahan
Permasalahan:
- Mengapa Aldehida lebih mudah mengalami reaksi adisi nukleofilik dibandingkan dengan keton?
- Aldehida dan keton mengalami reaksi dengan HCN untuk menghasilkan sianohidrin. Reaksi berlangsung sangat lambat dengan menggunakan hidrogen sianida murni. Bagaimanakah caranya agar reaksi dapat berlangsung lebih cepat sehingga menghasilkan sianohidrin yang sesuai?
- Mengapa aldehid lebih reaktif daripada keton pada reaksi adisi nukleofilik ini?
Jumat, 20 Maret 2020
Mekanisme Reaksi Bersaing SN2 dan E2
Mekanisme
Reaksi Bersaing SN2 dan E2
Pada suatu reaksi suatu alkil halide,jika
sebuah nukleofilik dan alkil halide kita reaksikan akan dimungkinkan dua reaksi
yaitu reaksi substitusi dan eliminasi. Reaksi sunstitusi itu dapat berlangsung
jika reagennya itu menyerang atom karbon, sedangkan pada reaksi eliminasi bisa
berlangsung jika reagennya itu menyerang atom hidrogen. Reaksi SN2 yang
bersaing ini kita hasilkan dari reaktan anionic yang melakukan penyerangan terhadap
nukleofil di pusat karbon alfa, yang menuju kepada tetjadinya pelepasan gugus
yang sama seperti terjadi pada reaksi E2.
Reaksi SN2 dan E2 bisa kita bilang reaksi bersaing. Kenapa karena pada mekanisme reaksi SN2 dan E2 ini, melalui keadaan yang sama. Keadaan yang mana saja? Keadaan menggunakan pelarut polar dan basa yang digunakannya ialah basa yang kuat. Misalnya, jika alkil halide sekunder yang digunakan, bisa dimungkinkan terjadi reaksi SN2 dan E2 yang menghasilkan produk campuran. Jika yang digunakan ialah basa lemah dan pelarut tak berproton yang polar , maka hasil suatu reaksi akan cenderung ke SN2. Lain pula jika yang kita gunakan ialah basa kuat seperti CH3CH2O- , NH2 atau OH hasil reaksi akan dominan ke E2.
Jika kita ingin mendalami lagi pada
reaksi bersaing yaitu SN2 dan E2 ini, reaksi SN2 akan labih gampang berlangsung
dibandingkan E2. Hal ini disebabkan karena keadaan reaksinya itu memakai basa
lemah atau kurang basa, peluang terjadinya reaksi eliminasi semakin besar
setara dengan naiknya tingkat kebasaan pada suatu reaksi.
Selanjutnya mari kita lihat
faktor-faktor apa saja yang mempengaruhi reaksi bersaing SN2 dan E2 ini:
1. Substrat
- Jika substrat yang dipakai ialah alkil halide primer, maka akan dominan ke substitusi. Disebabkan karena urutan alkil halide primer di dalam reaksi SN2 ini ialah sangat reaktif, dan kurang reaktif dalam reaksi E2.
- Jika substrat yang dipakai ialah alkil halide sekunder, maka akan menghasilkan hasil reaksi yang sama untuk substitusi maupun eliminasi. Semakin kuat nukleofil/basa menyebabkan semakin besar pula produk eliminasi yang dihasilkan, begitu juga sebaliknya.
- Jika substrat yang dipakai berupa alkil halide tersier, menyebabkan reaksi cenderung ke pada eliminasi. Karena alkil halide tersier lebih reaktif daripada alkil halide sekunder maupun primer pada reaksi E2 ini.
2. Struktur Basa
Basa
lemah itu cenderung pada memberikan hasil reaksi substitusi yang baik. Lain halnya
pada basa alkoksida dengan kekuatan yang sama, terbentuknya produk yang lebih
besar jika kita menggunakan basa alkoksida tersier daripada kita menggunakan
alkoksida primer dalam reaksi eliminasi.
3. Temperatur
Kenaikan temperature berbanding
lurus dengan laju reaksi substitusi dan eliminasi. Akan tetapi laju reaksi pada
eliminasi lebih besar disebabkan karena energi aktivasinya yang lebih tinggi.
Permasalahan
- Pada keadaan yang bagaimanakah SN2 dapat mendominasi reaksi bersaing ini?
- Bagaimana produk yang dihasilkan pada reaksi bersaing ini jika digunakan alkil halide sekunder?
- Pada kondisi yang bagaimana reaksi SN2 dan E2 dapat dikatakan bersaing?
Rabu, 11 Maret 2020
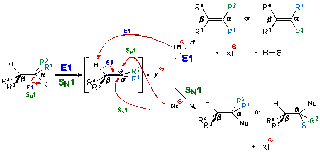
Mekanisme Reaksi Bersaing SN1 dan E1
Mekanisme Reaksi Bersaing SN1 dan E1
Perbedaan mendasar antara
kompetisi SN1 / E1 dan kompetisi SN2 / E2 adalah pada
langkah mekanistik pertama, atau dalam pembentukan ion karbenium, yang
sepenuhnya identik baik dalam eliminasi E1 dan reaksi SN1. Jadi,
pada langkah mekanistik pertama, reaksi E1 dan SN1 jelas tidak bersaing.
Persaingan muncul dari alternatif mekanistik mengikuti langkah pertama. Sama
seperti dalam kompetisi SN2 / E2, nukleofil (basa) dalam kompetisi SN1
/ E1 pada dasarnya bifungsional - yaitu, ia dapat mengabstraksi proton β dari
ion karbenium dalam eliminasi E1, atau secara langsung dapat menyerang α karbon
ion karbenium dalam reaksi SN1.
Lain dengan
kompetisi SN2 / E2, laju reaksi E1 dan SN1
bergantung pada struktur substrat tidak bertentangan, tapi dari jenis yang
sama. Reaksi SN1 ini, serta eliminasi E1, itu berjalan sangat lambat dengan
senyawa heteroalkil primer, membuat mereka itu biasanya sepenuhnya dilampaui
oleh mekanisme bimolekul yang sesuai (SN2 / E2). Jika kita lihat pada senyawa heteroalkil tersier, reaksi unimolecular (SN1
/ E1) berjalan lebih cepat jika kita bandingan dengan reaksi bimolecular (SN2
/ E2).
Gbr.1
Primer
α karbon: hijau
Gbr.2
sekunder
α karbon: hijau
Gbr.3
tersier
α karbon: hijau
Langkah dalam menentukan laju reaksi E1 dan SN1
yang identik ini yaitu pembentukan ion karbenium, yang bertanggung jawab pada
ketergantungan yang sama terhadap laju reaksi pada struktur substratnya. Karena
stabilisasi muatan positif ion karbenium oleh substituen alkil, energi
aktivasinya itu lebih rendah pada pembentukan ion karbenium tersier dibandingkn
untuk ion sekunder, atau, khususnya, untuk ion karbenium primer. Dengan begitu
laju reaksi senyawa heteroalkil tersier lebih besar jika dibandingkan dengan
senyawa heteroalkil sekunder atau primer (dalam SN1 dan E1).
Reaksi SN1 biasanya lebih dominan jika kita lihat dengan reaksi E1. Reaksi SN1 biasanya lebih dominan jika kita lihat dengan reaksi E1. Walaupun suhu sudah kita perbesar sedikit, guna memperbesar proporsi dari reaksi E1 ini, masih saja SN1 yang menjadi dominan.
Permasalahan
- Mengapa reaksi SN1 dan E1 pada senyawa heteroalkil primer itu reaksinya berjalan sangat lambat?
- Jelaskan pada saat keadaan yang bagaimanakah produk yang dihasilkan lebih dominan SN1?
- Bagaimanakah pengaruh suhu pada reaksi bersaing SN1 dan E1 ini?
Referensi
Minggu, 01 Maret 2020
MEKANISME REAKSI ELIMINASI E1
MEKANISME REAKSI ELIMINASI E1
Secara
keseluruhan, jalur ini merupakan proses yang multi-langkah dengan dua langkah
kritis berikut:
menghilangnya kelompok
yang meninggalkan, LG, untuk dihasilkan nantinya perantara karbokation,
kemudian
kehilangan
proton, H+, yang berasal dari karbokation untuk dapat membentuk
ikatan π.
Nah
sekarang mari kita lihat bagaimana berbagai komponen reaksi mempengaruhi jalur
reaksi:
R-
Urutan
reaktivitasnya bisa dilihat berikut ini: (CH3)3C-> (CH3)
2CH-> CH3CH2-> CH3-
Dalam
reaksi E1, tahap penentuan lajunya adalah menghilangnya gugus yang meninggalkan
untuk nantinya membentuk suatu karbokation antara. Semakin stabil karbokasinya,
maka semakin mudah terbentuk, dan sehingga semakin cepat reaksi E1. Karena reaksi
E1 itu berlangsung oleh zat-antara karbokation, sehingga alkil halida tersier
bereaksi lebih cepat jika kita bandingkan dengan alkil halida yang lain.
-LG
Satu-satunya
peristiwa yang dalam langkah penentuan tingkat E1 ialah pemutusan ikatan C-LG.
Oleh sebab itu, ada kebergantungan yang sangat kuat yang ada pada sifat
kelompok yang meninggalkan, semakin baik kelompok yang meninggalkan, menyebabkan
semakin cepat reaksi E1. Pada reaksi alkohol yang dikatalisis oleh asam, -OH nya
diprotonasi lebih awal guna memberikan ion oksonium, sehingga memberikan gugus
yang jauh lebih baik, molekul air (lihat skema di bawah).
B
Karena
basa disini tidak terlibat pada tahap penentuan laju, sifat basa ini tidak
penting dalam reaksi E1. Namun, semakin reaktif basa, maka semakin besar
kemungkinan reaksi E2 menjadi.
Selektivitas
Reaksi
E1 itu biasanya lebih disukai alkena yang lebih stabil sebagai produk utama:
yaitu lebih tinggi tersubstitusi alkil dan trans-> cis-Jalur mekanistik E1
ini paling umum dengan:
- kelompok meninggalkan yang baik
- karbokation stabil
- basis yang lemah.
Mekanisme
E1
Mekanisme
E1 yaitu proses dua langkah dan
langkahnya itu sama seperti pada mekanisme SN1, yaitu ionisasi
substratnya yang nantinya bisa menentukan laju (lambat) guna menghasilkan
karbokation.
Tahap kesatu dalam reaksi E1 identik dengan tahap pertama
reaksi SN1: ionisasi alkil halidanya. Tahap ini ialah tahap yang
berlangsung lambat, menjadi tahap penentu laju, dari suatu reaksi keseluruhan.
Reaksi E1 itu khasnya ditunjukkan dengan kinetika orde-pertama, yaitu laju
reaksinya itu bergantung hanya pada konsentrasi alkil halidanya saja.
Pada tahap kedua selanjutnya dalam reaksi eliminasi ini, basa
nya itu yang merebut sebuah proton yang berasal dari atom karbon yang letaknya itu
ibaratnya dekatan dengan karbon positif. Elektron ikatan sigma karbon-hidrogen
ini nantinya akan bergeser ke arah yang muatannya itu positif, sehingga karbonnya
mengalami rehibridasi yaitu dari keadaan sp3 ke sp2, dan nanti
akhirnya terbentuklah alkena.
Mekanisme
E1 untuk Alkil Halida
Langkah
1:
Pembelahan
ikatan C-X yang terpolarisasi ini akan memungkinkan hilangnya gugus yang meninggalkan
yang baik, ion halida ini untuk nantinya menghasilkan suatu perantara
karbokation. Ini ialah langkah penentuan laju (pemutusan ikatan adalah
mekanisme E1 untuk RX)
Langkah
2:
Reaksi
asam / basa. Deprotonasi yang dilakukan oleh basa (di sini ion alkoksida) dari
atom C yang posisinya dekatmdengan pusat karbokation yang mengarah ke pembentukan
C = C.
Permasalahan
- Mengapa pada reaksi E1 alkil halida tersier bereaksi lebih cepat dibandingkan alkil halida lain?
- Mengapa pada reaksi E1 laju reaksi hanya bergantung pada konsentrasi alkil halida saja?
- Mengapa pada reaksi E1 pada tahap pertamanya ialah terjadi ionisasi pada alkil halida?
Referensi
Fessenden & Fessenden. 1986. Kimia Organik Edisi Ketiga. Jakarta: Erlangga.
Hart,Harolt,dkk. Kimia Organik. Jakarta: Erlangga.
Langganan:
Komentar (Atom)