Mekanisme Reaksi Oksidasi pada Senyawa Organik
Reaksi antara suatu senyawa dengan oksigen biasanya disebut reaksi oksidasi ( Pada reaksi oksidasi oksigen yang dipakai bukan hanya gas oksigen bebas tetapi juga oksigen dari sumber lain) misalnya dai pekat dalam suasana asam dan suasana alkalis.Reaksi Oksidasi Alkohol
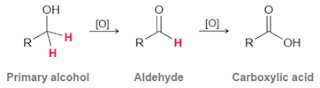
Alkohol primer bisa dioksidasi guna membentuk aldehida dan asam karboksilat; alkohol sekunder juga bisa dioksidasi yang nantinya menghasilkan keton. Pada alkohol tersier, sebaliknya, tidak bisa dilakukan oksidasi tanpa memutus ikatan molekul C-C.
Sebelumya kita sabaiknya untuk tau dulu bahwa alkohol itu bisa didapatkan dengan cara melalui suatu reaksi reduksi, pada penjelasan kali ini kita akan mengulas reaksi oksidasi alkohol.
Proses reaksi oksidasi alkohol menghasilkan suatu produk tergantung pada alkohol apa yang kita digunakan apakah itu alkohol primer, sekunder atau tersier. Yang pertama kali kita akan coba bandingkan reaksi oksidasi alkohol primer.
Alkohol sekunder hanya mempunyai satu proton yang ada pada posisi α sehingga menyebabkan hanya dapat dioksidasi sekali, menghasilkan keton.
Pada sebagian besar reagen tersedia untuk melakukan oksidasi terhadap alkohol primer dan sekunder. Reagen pengoksidasi yang paling sering dipakai ialah asam kromat (H2CrO4), yang bisa dibentuk dari chromium trioxide (CrO3) atau dari sodium dichromate (Na2Cr2O7) dalam larutan asam berair.
Mekanisme:
Mekanisme oksidasi dengan asam kromat mempunyai dua jalan utama. Jalan yang ke 1 ialah melibatkan pembentukan ester kromat, dan jalan ke 2 ialah denga proses E2 guna membentuk sebuah ikatan karbon-oksigen π (bukan ikatan karbon-karbon π).
Di bawah ini ialah mekanisme oksidasi alkohol dengan menakai asam kromat:
Jika kita ingin mendapatkan aldehida sebagai produk akhir, kita butuh reagen pengoksidasi yang lebih selektif, yang nantinya akan bereaksi dengan alkohol tapi tidak akan bereaksi dengan aldehida. kebanyakan seperti itu reagen tersedia, termasuk pyridinium chlorochromate (PCC). PCC didapatkan dengan cara dari reaksi antara piridin, kromium trioksida, dan asam klorida.
Ketika PCC dipakai sebagai agen pengoksidasi, aldehida dihasilkan sebagai produk utama. Dibawah situasi ini, aldehida tidak teroksidasi lebih lanjut membentuk asam karboksilat.
Metilen klorida (CH2Cl2) seringnya merupakan pelarut yang digunakan ketika PCC digunakan. Alkohol sekunder dioksidasi cuma sekali guna menghasilkan keton, yang stabil dalam kondisi pengoksidasi. Oleh sebab itu, alkohol sekunder bisa dioksidasi baik dengan PCC atau asam kromat.
Reagen CrO 3 / piridin (reagen Collins) akan mengoksidasi alkohol primer menjadi aldehida dan tidak berlanjut atau berhenti di situ. Namun, pada saat ada air, oksidasi ini akan menjadi asam karboksilat.
Reagen untuk Oksidasi Alkohol
Untuk oksidasi alkohol primer menjadi aldehida
Cr 2 O 7 2– (dikromat)
CrO 3 / piridin (reagen Collins)
Pyridinium chlorochromate (PCC)
Pyridinium dichromate (PDC, reagen Cornforth)
Dess – Martin periodinane
Dimethylsulfoxide (DMSO) / oxalyl chloride (Swern oksidasi)
dll.
Untuk oksidasi alkohol sekunder menjadi keton
Cr 2 O 7 2– (dikromat)
CrO 3 / piridin (reagen Collins)
Pyridinium chlorochromate (PCC)
Pyridinium dichromate (PDC, reagen Cornforth)
Dess – Martin periodinane
Dimethylsulfoxide (DMSO) / oxalyl chloride (Swern oksidasi)
CrO 3 / H 2 SO 4 / aseton (oksidasi Jones)
Aluminium isopropoksida / aseton (oksidasi Oppenauer)
Untuk oksidasi langsung dari alkohol primer menjadi asam karboksilat
KMnO 4 (potassium permanganate)
RuO 4 (ruthenium tetroxide)
CrO 3 / H 2 SO 4 / aseton (oksidasi Jones)
- Piridin (reagen Collins) akan mengoksidasi alkohol primer menjadi aldehid dan berhenti disitu. Namun, ketika ada air, oksidasinya akan menjadi asam karboksilat. Mengapa dengan media air oksidasi akan berlanjut sehingga akan menghasilkan asam karboksilat?
- Mengapa alkohol tersier tidak bisa dioksidasi?
- Alkohol primer bisa dioksidasi membentuk aldehid dan teroksidasi lebih lanjut menghasilkan asam karboksilat. Pada saat keadaan yang bagaimana aldehid tidak teroksidasi lebih lanjut menjadi asam karboksilat?
Referensi
David R. And Klein. 2012. Organic Chemistry. Johns Hopkins University. John
Wiley and Sons. United States of America.













Saya Denora Situmorang (056)
BalasHapusSaya akan mencoba menjawab permasalahan saudari wisliana no.3 diman pada reaksi oksidasi alkohol primer terjadi dua tahap dimana pada tahap pertama akan terbentuk keton sementara jika reaksi berkelanjutan makan akan terbentuk asam karboksilat, agar reaksi ini tidak berkelanjutan maka harus dilakukan destilasi untuk mengindari terjadinya proses oksidasi berkelanjutan.
Terimakasih
Saya Nadiya NIM A1C118073 akan mencoba menyelesaikan permasalahan pertama. Piridin akan mengoksidasi alkohol primer menjadi aldehid dan berhenti disitu. Namun, ketika ada air, oksidasinya akan menjadi asam karboksilat hal tersebut dikarenakan terjadinya reaksi antara aldehid yang telah terbentuk dengan air yang ada. Mekanisme reaksi ini memiliki dua langkah. Pada langkah pertama, air yang ada bergabung dengan adanya katalis asam untuk menghasilkan hidrat. Selanjutnya, hidrat dioksidasi menjadi asam karboksilat secara formal menghilangkan air. Hingga terbentuklah asam karboksilat.
BalasHapusSaya Susilawati (091) akan menjawab permasalahn no 2 yang anda paparkan
BalasHapusAlkohol tersier tidak dapat dioksidasi sebab tidak memiliki ikatan dengan atom hidrogen (H). Karena tidak ada hidrogen yang bisa dilepaskan untuk bereaksi dengan oksigen maka tidak bisa terjadi reaksi oksidasi.
semoga membantu.